◎皮膚良性色素性疾患の治療システムALEX IIの日本市場投入に向け、Syneron-Candelaが薬事承認を取得
AsiaNet 56609
【編註】クライアントからの要請により、提供された原稿をそのまま配信します。
共同通信JBNでは一切編集を行っておりません。
皮膚良性色素性疾患の治療システムALEX IIの日本市場投入に向け、Syneron-Candelaが薬事承認を取得
東京、 2014年4月24日/PRNewswire/ --
世界有数の美容医療機器会社、Syneron Medical Ltd. (NASDAQ:ELOS)は本日、同社の子会社である日本のキャンデラ株式会社が、皮膚良性色素性疾患の治療システムALEX II(TM)の薬事承認を厚生労働省から取得したと発表しました。
(ロゴ: リンク )
Candelaが自信を持って提供するAlex TriVantage(R)プラットフォームを日本市場向けに特別にカスタマイズしたALEX IIは、先天性色素性病変や入れ墨の治療目的で設計された単一波長のQ-スイッチアレキサンドライトレーザーです。日本人の肌タイプに多くみられる色素性病変の治療目的で、特に日本で導入率の高い波長755nmのQ-スイッチアレキサンドライトレーザーシステムの第二世代に相当します。2ミリ、3ミリ、4ミリメートルのスポットサイズの治療および、最大18 J/cm2までのフルエンスまで照射することが可能です。
「日本でよく使用されるQ-スイッチルビーレーザー、Q-スイッチNd:YAGレーザーと比べても、CandelaのQ-スイッチアレキサンドライトレーザーは臨床的にバランスが取れていると考えています。最適な波長と照射時間により、治療中の合併症のリスク、特に色素脱失を抑えつつ、高い有効性を得ることが可能です。」と、東海大学形成外科准教授の河野太郎博士は述べ、次のように続けました。「10年以上ALEXLAZRを使用してきましたが、CandelaのQ-スイッチアレキサンドライトレーザーを用いた治療には多くの利点があると感じています。」
現在、日本では約500台の ALEXLAZRが稼働していますが、今後、最先端技術を持つALEX IIに更新され、より優れた結果をもたらすようになると期待されています。
今回、厚生労働省による薬事承認を得たことで、健康保険の適用が可能となり、医師と患者双方が利益を得ることになります。太田母斑、異所性蒙古斑、外傷性刺青などの先天性色素性病変を有する患者は、3ヶ月おきに国民健康保険による治療を受けることができます。
「波長755 nmのALEX II Q-スイッチアレキサンドライトレーザーシステムが、日本での薬事承認を受けたことを光栄に思っています」と、キャンデラ株式会社代表取締役社長の森敏雄は述べ、次のように続けました。「日本の医師と患者にとって、当社のALEX IIがもたらす有効性に優れた治療が身近になることは、当社の世界的な販売戦略にとっても重要と考えています。」
Syneron Medical Ltd.について
Syneron Medical Ltd.(シネロン・メディカル)(ナスダック:ELOS)は、世界的な美容機器トップメーカーで総合的な製品群と世界的な販売網を持っています。同社の技術によって、痩身、脱毛、しわ取り、血管性病変、メラニン病変の治療、肌の若返り、さらにニキビや下肢静脈瘤の治療、セルライト除去を含む幅広い目的の先進的なソリューションを医師は患者に提供することができます。同社はSyneron製品、Candela製品の2つのブランドを販売していいます。2000年に創立されたSyneron Medical Ltd.の本社、研究開発、製造本部はイスラエルにあります。Syneron Medical Ltd.はまた米国にも研究開発、製造事業所があります。同社は90カ国で製品を販売、サービスサポート体制も整っています。北米、フランス、ドイツ、イタリア、ポルトガル、スペイン、英国、オーストラリア、中国、日本、香港にオフィスを構え、世界に販売代理店があります。
詳しい情報は、ウェブサイトリンクを参考してください。
将来の見通しに関する記述(セーフハーバー条項)
本ニュースリリースには、リスクや不確実性に関する1995年私募証券訴訟改革法の適用範囲内にある将来の予想に関する記述が含まれています。このような将来の見通しに関する記述には、潜在的な臨床的成功、予定された規制当局の承認や将来の製品の発売、予測収益、利益率、利益および市場シェアなどといった、期待、計画、企業の見通しによるものが含まれます。企業の見通しによる記述は、経営陣の現在の予測に基づいており、実際の結果が将来の見通しに関する記述に記載されている内容と大きく異なる可能性があり、一定のリスクや不確実性の影響を受けます。これらのリスクと不確実性には、市場の状況、新製品の市場での反響、および企業のコントロール可能な範囲外にある他の要因、リスク要因、様式20 - Fに基づく企業の最新の年次報告書に記載されている内容、およびSyneron Medical Ltd.が行ったSECへの提出書類に記載されたその他の要因を含む、その他の注意書きがあります。これらの要因の1つ以上が具体化、またはいずれかの基礎となる前提が正しくなかったことが判明した場合、Syneron Medical Ltd.の実際の業績、パフォーマンス、または成果は、将来における業績、パフォーマンス、または成果に関して明示または黙示に行われた将来の予想に関する記述と著しく異なる場合があります。これらの将来の予想に関する記述は、この文書の作成日付後にあってはいかなる場合でも、Syneron Medical Ltd.の公式的な見解を示す効力を有しません。本記述の更新は意図されておらず、いかなる状況、人物に対しても、本記述の更新の義務を負うものではありません。
お問い合わせ先:
ルースグループ、Zack Kubow、 +1-646-536-7020 zkubow@theruthgroup.com
最高財務責任者、Hugo Goldman、Hugo.Goldman@syneron.com
Syneron Medical Ltd. - 広報、pr@syneron.com
情報元: Syneron Medical Ltd.
御社のプレスリリース・イベント情報を登録するには、ZDNet Japan企業情報センターサービスへのお申し込みをいただく必要がございます。詳しくは以下のページをご覧ください。
 メルカリが「2四半期連続のMAU減少」を恐れない理由--日本事業責任者が語る【インタビュー】
メルカリが「2四半期連続のMAU減少」を恐れない理由--日本事業責任者が語る【インタビュー】
 なぜPayPayは他のスマホ決済を圧倒できたのか--「やり方はADSLの時と同じ」とは
なぜPayPayは他のスマホ決済を圧倒できたのか--「やり方はADSLの時と同じ」とは
 AIが通訳するから英語学習は今後「オワコン」?--スピークバディCEOの見方は
AIが通訳するから英語学習は今後「オワコン」?--スピークバディCEOの見方は
 パラマウントベッド、100人の若手が浮き彫りにした課題からCVCが誕生
パラマウントベッド、100人の若手が浮き彫りにした課題からCVCが誕生
 野村不動産グループが浜松町に本社を「移転する前」に実施した「トライアルオフィス」とは
野村不動産グループが浜松町に本社を「移転する前」に実施した「トライアルオフィス」とは
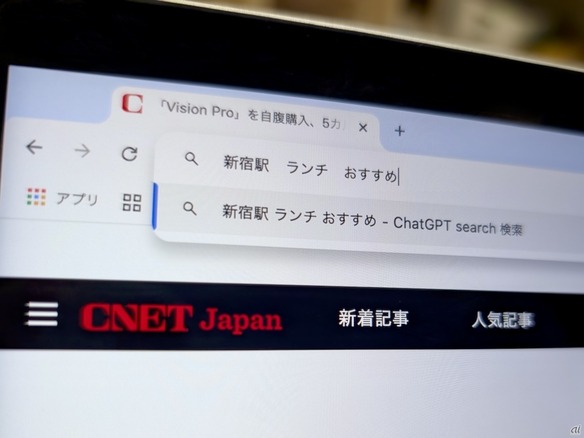 「ChatGPT Search」の衝撃--Chromeの検索窓がデフォルトで「ChatGPT」に
「ChatGPT Search」の衝撃--Chromeの検索窓がデフォルトで「ChatGPT」に
 「S.RIDE」が目指す「タクシーが捕まる世界」--タクシー配車のエスライド、ビジネス向け好調
「S.RIDE」が目指す「タクシーが捕まる世界」--タクシー配車のエスライド、ビジネス向け好調
 物流の現場でデータドリブンな文化を創る--「2024年問題」に向け、大和物流が挑む効率化とは
物流の現場でデータドリブンな文化を創る--「2024年問題」に向け、大和物流が挑む効率化とは
 「ビットコイン」に資産性はあるのか--積立サービスを始めたメルカリ、担当CEOに聞いた
「ビットコイン」に資産性はあるのか--積立サービスを始めたメルカリ、担当CEOに聞いた
 培養肉の課題は多大なコスト--うなぎ開発のForsea Foodsに聞く商品化までの道のり
培養肉の課題は多大なコスト--うなぎ開発のForsea Foodsに聞く商品化までの道のり
 過去の歴史から学ぶ持続可能な事業とは--陽と人と日本郵政グループ、農業と物流の課題解決へ
過去の歴史から学ぶ持続可能な事業とは--陽と人と日本郵政グループ、農業と物流の課題解決へ
 通信品質対策にHAPS、銀行にdポイント--6月就任のNTTドコモ新社長、前田氏に聞く
通信品質対策にHAPS、銀行にdポイント--6月就任のNTTドコモ新社長、前田氏に聞く
 「代理店でもコンサルでもない」I&COが企業の課題を解決する
「代理店でもコンサルでもない」I&COが企業の課題を解決する